V laboratořích Ústavu organické chemie a biochemie AV ČR studuje naše skupina pod vedením RNDr. Václava Čeřovského, CSc. antimikrobiální peptidy, látky, které mají potenciál léčit špatně se hojící infekce, kde běžně používaná antibiotika již ztratila svou účinnost. „Během naší práce tyto antimikrobiální peptidy, původně objevené v jedových žlázách divoce žijících včel, charakterizujeme a dále vylepšujeme – tzn., měníme chemicky jejich strukturu, abychom zvýšili jejich účinek proti patogenním mikroorganismům a zároveň snížili jejich toxicitu vůči lidským buňkám,“ říká doktorand Ondřej Nešuta.
V druhé polovině 20. století zažila lidská společnost velký rozmach v používání antibiotik. Onemocnění, která do té doby ohrožovala lidské životy, mohla být najednou vyléčena v řádech dnů. Bohužel představa, že se jednou provždy podařilo zahnat hrozbu smrtelných infekcí, se brzy ukázala jako mylná. Neuváženým a často neopodstatněným používáním těchto specifických léčiv došlo k celosvětovému rozšíření mikrobů, které již dokážou účinkům antibiotik odolávat. Dnes se podle Světové zdravotnické organizace ocitáme v době „post-antibiotické“, kdy se tzv. „multi-resistentní“ kmeny mikrobů (tj. kmeny odolné proti působení více druhů antibiotik) rozšířily celosvětově a nových antibiotik nepřibývá pro nízký ekonomický zájem farmaceutických společností. Pomalu se tak ocitáme v situaci, ve které jsme byli před objevem prvních antibiotik. „A právě zde je obrovský potenciál námi studovaných látek,“ vysvětluje Ondřej Nešuta.
Antimikrobiální peptidy se vyvinuly jako součást imunitního systému nejrůznějších organismů včetně člověka a, jak už jejich název napovídá, jsou schopny rychle a účinně zabíjet patogenní mikroorganismy, jako jsou bakterie, kvasinky či viry. Z chemického hlediska jsou peptidy řetězce aminokyselin navzájem propojených tzv. peptidovou vazbou, tj. vazbou mezi karboxylovou skupinou jedné aminokyseliny a aminoskupinou té následující (Obr. 1). Aminokyseliny obsahují vedle amino-skupiny a karboxylu ještě postranní řetězec, který určuje jejich fyzikálně-chemické vlastnosti. Právě pořadí a zastoupení jednotlivých aminokyselin v peptidovém řetězci ovlivňuje celkovou strukturu a charakter peptidu. Jednoduše si lze peptidy představit jako šňůru perel, kde má každá z nich jiný charakter. Společně pak jako celek tyto perly určují, jak bude výsledný náhrdelník, čili peptid, vypadat. V přírodě mají antimikrobiální peptidy obvykle délku 10–50 aminokyselin a různé prostorové uspořádání. Nejčastěji se vyskytují ve formě šroubovic (tzv. α-helixů), tzv. skládaných listů a smyček nebo jejich kombinací. Pro antimikrobiální peptidy je typické, že obsahují větší množství kladně nabitých (bazických) aminokyselin – lysinu a argininu a asi 50 % hydrofobních aminokyselin. Toto specifické složení se promítá do prostorového uspořádání molekuly peptidu, které vykazuje tzv. amfipatický charakter. To znamená prostorově oddělené hydrofobní a hydrofilní (polární) oblasti – např., v případě lineárních peptidů jsou postranní řetězce hydrofobních aminokyselin rozloženy na jedné straně a postranní řetězce polárních aminokyselin (včetně těch bazických) na opačně straně šroubovice (Obr. 2).

Obr. 1: Aminokyseliny jsou v peptidu seřazeny jako šňůra perel. Jednotlivé aminokyseliny jsou mezi sebou spojeny tzv. peptidovou vazbou (označena žlutě). Typ a pořadí aminokyselin určuje celkový charakter peptidu.

Obr. 2: Přírodní peptid izolovaný z jedu divoké včely Hylaeus signatus v naší laboratoři. Aminokyseliny peptidu jsou uspořádány do šroubovice, která má tzv. amfipatický charakter. Tzn., postranní řetězce hydrofobních aminokyselin ční na jednu a postranní řetězce polárních aminokyselin se třemi kladně nabitými lysiny na druhou stranu šroubovice.
Antimikrobiální peptidy působí mechanismem, který jim umožňuje působit pouze na patogenní mikroorganismy a zároveň neuškodit buňkám lidského těla. Jak je to možné? Tato selektivita je dána rozdíly ve stavbě buněk. Bakteriální buňky mají membrány složené z fosfolipidů nesoucí záporný náboj (fosfatidylglycerol, fosfatidylserin a kardiolipin). Ty, společně s dalšími povrchovými strukturami (buněčnou stěnou u Gram-negativních nebo lipopolysacharidem u Gram-negativních bakterií), udávají buňkám celkově negativní náboj, čímž elektrostaticky přitahují kationické antimikrobiální peptidy. Na rozdíl od toho lidské (živočišné) buňky obsahují ve svých membránách spíše neutrální fosfolipidy (fosfatidylcholin a fosfatidylethanolamin) a cholesterol, který membránu navíc stabilizuje. Antimikrobiální peptidy s bakteriální membránou interagují, zanořují se do ní svou hydrofobní částí a vytvářejí v ní póry (nebo jinak narušují její integritu), což vede k úniku životně důležitých látek z buňky ven a jejímu zániku (Obr. 3). Existuje ovšem i skupina antimikrobiálních peptidů, které membránu neporuší, pouze skrz ní projdou dovnitř buňky a zablokují některý z metabolických procesů. Důležité je, že antimikrobiální peptidy působí rychle, v řádu desítek minut, a spíše fyzikálním mechanismem na celém povrchu buňky, proto je málo pravděpodobné, že by si mikroby vůči nim vypěstovaly resistenci.
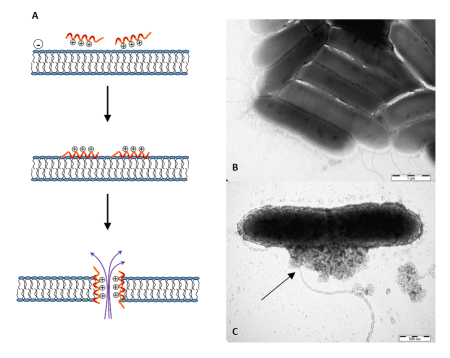
Obr. 3: (A) Mechanismus působení antimikrobiálních peptidů: Kationické peptidy jsou elektrostaticky přitahovány k negativně nabitému povrchu bakteriální buňky. Interagují s membránou a svou hydrofobní částí se zanořují do fosfolipidové dvojvrstvy, čímž ji rozrušují. Výsledkem je vznik pórů, jimiž bakterie ztrácí životně důležitý obsah a zaniká.
Fotografie z elektronového transmisního mikroskopu ukazují patogenní bakterie Pseudomaonas aeruginosa (B) před a (C) po působení antimikrobiálního peptidu. Ten způsobil porušení bakteriální membrány a vylití buněčného obsahu (šipka).
„Jak práce v naší laboratoři vypadá? Zabýváme se studiem antimikrobiálních peptidů, které jsme objevili v jedu divokých včel. Všechno začíná u entomologů, kteří po identifikaci dané včely vypreparují její jedovou žlázu. Tu u nás potom extrahujeme organickými rozpouštědly a extrakt rozdělíme pomocí vysokoúčinné kapalinové chromatografie (HPLC). Tento přístroj nám umožní oddělit od sebe jednotlivé složky jedu na základě jejich fyzikálně-chemických vlastností. Pokud některá ze složek brání v růstu bakterií na Petriho misce, analyzujeme ji pomocí Edmanova odbourávání a hmotnostní spektrometrie. Metoda Edmanova odbourávání nám prozradí přesné pořadí aminokyselin v peptidovém řetězci a hmotnostní spektrometrie nám zase určí přesnou molekulovou hmotnost peptidu. Jakmile známe oba tyto parametry, připravíme si peptid v naší laboratoři synteticky v dostatečném množství a čistotě, protože v přírodním materiálu se obvykle nachází jen velmi malé množství těchto látek. U takto připraveného peptidu následně stanovujeme jeho antimikrobiální aktivitu a toxicitu. Tj., testujeme ho proti široké škále patogenních bakterií a kvasinek (včetně např. methicilin-rezistentnímu zlatému stafylokoku – MRSA, či kvasince rodu Candida) a měříme jeho hemolytickou aktivitu – zda způsobuje rozpad lidských červených krvinek. Na základě těchto hodnot pak pomocí cílené záměny aminokyselin v řetězci přírodního peptidu připravujeme analoga s vylepšeným antimikrobiálním účinkem a nízkou toxicitou.
Tím však naše práce nekončí. U takto získaných antimikrobiálních peptidů dále podrobně zkoumáme např., jaký je přesný tvar jejich molekul, jak se změní chování bakterií v jejich přítomnosti, jakým způsobem a jak rychle dochází k porušení celistvosti bakteriálních buněk nebo zda mohou bakterie tyto peptidy degradovat. Věříme, že všechny tyto informace nám ve výsledku pomohou vymyslet a připravit ideální molekulu, která bude schopna jednou opravdu nahradit dnešní antibiotika,“ upřesňuje Ondřej.

