Je sodno-draselná ATPasa pouze transportním proteinem?
Objevy učiněné v posledních letech vrhají na Na+/K+-ATPasu nové světlo.
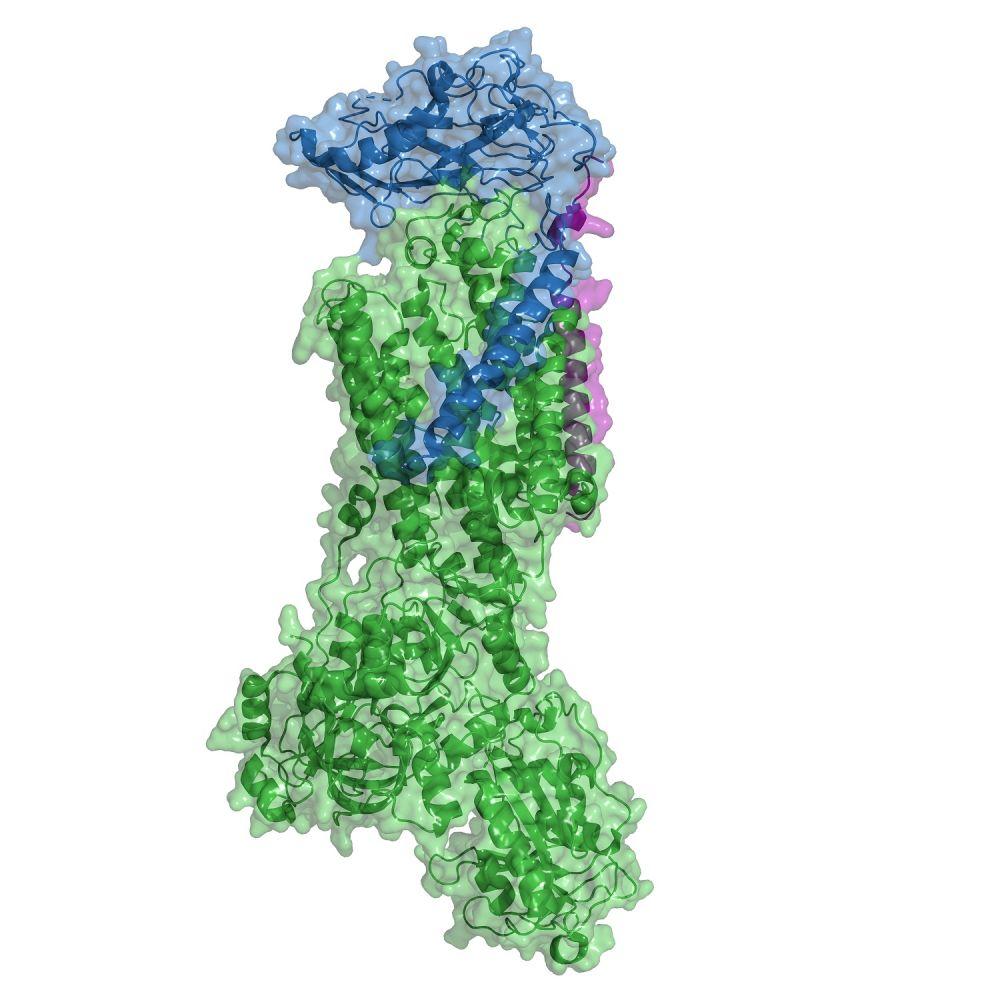
Sodno-draselná ATPasa (Na+/K+-ATPasa; NKA), protein přítomný v živočišných buňkách, byla objevena v roce 1957 dánským biochemikem Jensem Christianem Skouem, který za tento objev obdržel o čtyři desetiletí později Nobelovu cenu za chemii. Dlouhou dobu se předpokládalo, že tento protein zaujímá v buňce pouze úlohu aktivního transportu sodných a draselných iontů přes cytoplasmatickou membránu. Nicméně v posledních desetiletích se pohled na NKA značně proměnil a stal se z ní významný prvek signalizační kaskády a také cíl potenciálních protinádorových léčiv.
J. C. Skou se původně zabýval studiem schopnosti lokálních anestetik pronikat do monovrstvy nervových membránových lipidů. Tuto schopnost měřil jako změnu povrchového tlaku monovrstvy a jako indikátor těchto změn mu sloužil protein, který původně považoval za sodný kanál. V roce 1957 publikoval výsledky studie zaměřené právě na tento protein. V té době již věděl, že se jedná o ATPasu a ačkoli provedené experimenty ukázaly, že na transportní funkci mají vliv sodík, draslík, vápník a hořčík, stále se domníval, že transportovaným iontem je pouze sodík. Z tohoto důvodu dal také svému odbornému článku, kde svůj objev publikoval, poněkud zdrženlivější název: „The influence of some cations on an adenosine triphosphatase from peripheral nerves“. Nicméně výzkum v této oblasti neustával a v 60. letech minulého století již bylo z článků publikovaných J. C. Skouem a dalšími zřejmé, že zmíněný protein je skutečně NKA a dokonce, že je NKA schopna za vhodných termodynamických podmínek naopak ATP syntetizovat z ADP a fosfátu.
Spolu s tím, jak se prohlubovalo poznání o NKA samotné, rostlo množství informací ohledně modulátorů její aktivity. Mezi nejznámější modulátory aktivity NKA patří kardioglykosidy (KG), látky přírodního původu, které se vyskytují v širokém spektru rostlin, především pak z rodu náprstníků (Digitalis). Podstatou biologického působení KG je inhibice NKA, která v konečném důsledku zvyšuje intracelulární koncentraci Ca2+ iontů a dochází tak k zesílení svalové kontrakce. Mezi nejznámější zástupce KG patří digitoxin a digoxin, které se z tohoto důvodu využívají v léčbě srdečního selhání a srdečních arytmií. Nicméně v současné době se interakce KG s NKA studují v souvislosti s možným využitím v léčbě rakoviny.
Protirakovinné působení KG ve spojitosti s NKA tkví ve dvou odlišných mechanismech. První mechanismus byl znám už v minulém století a je jím již zmíněná inhibice NKA. Zvýšená intracelulární koncentrace Ca2+ sice zesiluje svalovou kontrakci, nicméně v dlouhodobém horizontu způsobuje apoptózu buňky. Hranice mezi těmito ději je tenká a právě proto mají KG poměrně úzké terapeutické okno.
Druhý mechanismus působení KG byl objeven až na přelomu tisíciletí. V tomto případě je důležité, aby koncentrace KG byla dostatečně nízká a nedocházelo tak k inhibici NKA. Za takové situace jsou aktivovány signalizační kaskády, které následně stimulují buněčnou proliferaci. Avšak tímto způsobem působí KG v nenádorových buňkách. Oproti tomu v nádorových buňkách dochází k potlačení buněčné proliferace, a ačkoli bylo popsáno, že i v tomto případě hrají úlohu signalizační kaskády, přesný mechanismus nebyl dosud objasněn.
V naší laboratoři na Ústavu biochemie a mikrobiologie VŠCHT Praha se zabýváme studiem KG z hlediska jejich možného využití v terapii a diagnostice nádorových onemocnění. Studujeme vlastnosti jak nemodifikovaných přírodních látek, tak i jejich konjugátů s různými fluorescenčními molekulami, které umožní jejich vizualizaci a díky tomu uplatnění nejen v terapii, ale také v diagnostice (tedy teranostice) nádorových onemocnění. V naší práci využíváme výpočetní techniku k modelování interakcí studovaných molekul s NKA. Rovněž se zajímáme o jejich cytotoxické vlastnosti, konkrétně o to, jak se po strukturní modifikaci změní cytotoxicita a z toho vyplývající selektivita vůči nádorové tkáni. Důležitá je také znalost lokalizace látek ve specifických buněčných kompartmentech, protože díky tomu víme, zda si modifikovaná látka zachovala svoji funkčnost. Získané poznatky nás pak přibližují k vysněnému cíli, kterým by byla molekula s ideálními vlastnostmi pro léčbu nádorových onemocnění. To vše díky proteinu, který byl dříve považován za „pouhý“ nástroj pro transport iontů v buňce.
Autor je doktorským studentem na Ústavu biochemie a mikrobiologie







