Jak se rodí solvatovaný elektron?
Tým vědců z ETH v Curychu a VŠCHT v Praze poprvé pozoroval v reálném čase zrod tzv. solvatovaného elektronu při radiolýze vody. Výsledky ukazují na nové možnosti ultrarychlých časově rozlišených spektroskopií, kdy je možné sledovat pohyby nejen atomů, ale i elektronů při chemických reakcích. Výsledky práce byly nyní publikovány v časopise Science Advances.
Chemie začátku 19. století zažívala jednu ze svých revolucí. Jedním z jejich vůdců byl i Humphry Davy, který elektrolýzou připravil sodík a draslík. V té době se také začalo dařit zkapalňovat plyny, mimo jiné i amoniak. Když se do kapalného amoniaku vloží sodík, vznikne roztok podmanivě modré barvy. O sto let později byla tato barva přisouzena rozpuštěnému (solvatovanému) elektronu, odtrhnutému od atomu sodíku.
Pokus rozpustit sodík v nejběžnější kapalině – vodě – skončí explozí. Solvatovaný elektron ve vodě lze ale připravit i jinak – její radiolýzou, účinkem ionizujícího záření. I když solvatovaný elektron žije pak jen krátce, necelých 300 mikrosekund, jeho význam pro celou řadu procesů v chemii nebo biologii je ohromný. Tak například, jaderný reaktor se solvatovanými elektrony jen hemží.
To vše bylo jasné už od šedesátých let, přesto byl zrod solvatovaného elektronu v reálném čase zachycen až nyní švýcarským týmem prof. Hanse Jakoba Wörnera z ETH v Curychu. Interpretace experimentů pomocí technik molekulární kvantové mechaniky pak byla na týmu prof. Petra Slavíčka z VŠCHT Praha. Výsledky studie byly nyní publikovány v časopise Science Advances.
Solvatovaný elektron vzniká během několika femtosekund (1 fs = 10-15 s) po ozáření vody. Jde tak o jednu z nejrychlejších pozorovaných reakcí vůbec. Elektron ve vodě se zrodí díky přeskoku atomu vodíku z jedné molekuly vody na druhou. Vznikne tak radikál H3O – ten má stejný počet elektronů jako sodík a jeden elektron se z něj okamžitě odlupuje. Experimentátoři pak sledují osudy právě tohoto elektronu s použitím velmi krátkých laserových pulzů, ale bez kvantové teorie by bylo jen velmi obtížné říci, co se s elektronem po jeho zrodu vlastně děje.
„Je to pro mne i pro VŠCHT hlavně učitelský úspěch“, říká prof. Slavíček. První autorem a hlavní experimentátor je totiž Dr. Vít Svoboda, absolvent zdejšího studijního oboru Chemie. Vít Svoboda získal na VŠCHT také inženýrský titul v oboru fyzikální chemie s diplomovou prací vykonanou na Ústavu fyzikální chemie Jaroslava Heyrovského, ale s prof. Slavíčkem úzce spolupracoval – je mj. spoluautorem učebního textu Kvantová chemie: První čtení, který vyšel loni v nakladatelství VŠCHT. Na doktorát se přesunul již do Curychu, kde se zabývá rychle se rozvíjející oblastí fyziky a chemie na attosekundové (1 as = 0,001 fs) časové škále.
„Vítek mne kontaktoval asi před rokem, s tím, že mají pěkná experimentální data a zda k tomu nemáme co říct“, pokračuje Petr Slavíček. Jeho tým se účinky záření na kapaliny věnuje již nějakou dobu a potřebná data měli v podstatě v šuplíku – jen do dneška nebyl k dispozici experiment, který by je podpořil. Propojení teorie a experimentu vedlo k detailnímu pohledu na mechanismus tvorby solvatovaného elektronu. Je to další krůček k pohledu na chemické reakce. Ještě v sedmdesátých letech nám muselo stačit, že pozorujeme látky před a po reakci, od osmdesátých let bylo možné pozorovat i tanec atomů při chemických reakcích. A dnes pozvolna začíná být možné pozorovat i pohyby elektronů v průběhu chemické reakce. Důležité je i to, že experimenty byly provedeny v laboratoři. Podobné experimenty se totiž provádí hlavně na zařízeních jako je tzv. laser s volnými elektrony (free-electron laser) nebo zařízeních podobných ELI Beamlines, tedy za mnohanásobně vyšších nákladů.
Doplňující informace
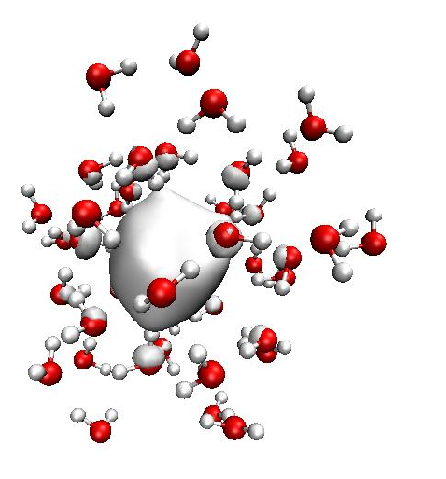
Podle současných představ vytváří solvatovaný elektron kavity ve vodě, i když struktura solvatovaných elektronů je stále předmětem debat. Postupnou tvorbu takovýchto struktur po ozáření vody sledovali autoři z ETH v Curychu a na VŠCHT Praha.

Experimentátoři měřili tzv. fotoelektronová spektra, ze kterých je možné zjistit, jak silně jsou elektrony navázány v molekulách či materiálech. Tento přístup je zcela běžný v materiálové chemii, švýcarský tým je ale schopný je provádět s extrémně jemným časovým rozlišením. Pracují přitom se shluky molekul, tzv. klastry.

Reference
Real-time observation of water radiolysis and hydrated electron formation induced by extreme-ultraviolet pulses BY VÍT SVOBODA, RUPERT MICHIELS, AARON C. LAFORGE, JAKUB MED, FRANK STIENKEMEIER, PETR SLAVÍČEK, HANS JAKOB WÖRNER, SCIENCE ADVANCES, : EAAZ0385







