Lék z jedu včely místo antibiotika?
Doktorandka Ústavu biochemie a mikrobiologie, Ing. Tereza Tůmová, spolupracuje s kolegy z ÚOCHB AV ČR na výzkumu nových typů antimikrobiálních látek a léčiv, jejichž vývoj je nutný, protože mikroorganismy jsou stále odolnější vůči klasickým antibiotikům. Jak se takovýto výzkum dělá? Molekuly antimikrobiálních látek se nacházejí v celé řadě organismů. Výzkumný tým z ÚOCHB AV ČR se zabývá jejich izolací z jedových váčků včel Halictus sexcintus. Tyto molekuly antimikrobiálních látek, v tomto případě peptidů, se vyznačují vysokým kladným nábojem, který ovlivňuje jejich antimikrobiální aktivitu velmi významně. Ing. Tereza Tůmová a skupina Dr. Kašičky analyzuje právě fyzikálně-chemické vlastnosti těchto molekul, aby se dalo lépe předpovědět jejich využití ve formě léčiv. Jak se taková molekula s kladným nábojem charakterizuje pomocí kapilární elektroforézy?
Stanovení efektivního náboje antimikrobiálních peptidů pomocí kapilární elektroforézy
Nárůst rezistence mikroorganismů vůči klasickým antibiotikům, jakými jsou např. peniciliny a tetracykliny, vyžaduje, aby byly hledány a zkoumány nové typy antimikrobiálních látek a léčiv. Pracovníci Ústavu organické chemie a biochemie Akademie věd České republiky se výzkumem takovýchto molekul, izolovaných z hmyzu, zabývají již téměř deset let. Jde o antimikrobiální peptidy, unikátní svým silným kladným nábojem, který hraje významnou roli v antimikrobiálním účinku. Přesné určení náboje peptidu je tedy podstatné pro vysvětlení mechanismu antimikrobiální aktivity. Jednou z metod pro stanovení efektivního náboje molekuly, vedle např. výpočetní chemie, je kapilární elektroforéza.
Antimikrobiální peptidy byly izolovány z celé řady organismů, např. hmyzu, žab i savců. My se zabýváme analýzou a charakterizací peptidů objevených skupinou Dr. Čeřovského v jedových váčcích hmyzu, především včely Halictus sexcintus. Dle tohoto původu byly peptidy pojmenovány haliktiny. Jde o molekuly tvořené řetězci 10-12 aminokyselin spojených peptidovou vazbou. Pro představu je dobré přirovnání aminokyselin v peptidovém řetězci k podobě kuliček navlečených na provázku. Tyto aminokyseliny mají různé postranní řetězce, tj. části molekuly, které jim dávají specifické vlastnosti. Pro nás je u haliktinů podstatná přítomnost aminokyselin, které nesou bazické postranní skupiny a celé molekule peptidu tak udělují kladný náboj. Jeho velikost se však liší v závislosti na pH prostředí, ve kterém se peptid nachází.
Z dosavadního pozorování je zřejmé, že kladný náboj peptidu je důležitou vlastností pro antimikrobiální aktivitu, neboť právě interakce kladného náboje peptidu se záporně nabitou membránou bakterií je podstatou účinku. Přesné určení jeho velikosti by pomohlo lépe vysvětlit mechanismus účinku i navrhnout ještě účinnější molekuly.
V prostředí o různém pH se velikost náboje peptidu mění díky disociaci resp. protonizaci postranních skupin aminokyselin. Hodnota pH, při které dochází k disociaci resp. protonizaci dané skupiny z 50 % je určena tzv. kyselou disociační konstantou této skupiny. Průměrné hodnoty disociačních konstant aminokyselin jsou dostupné v literatuře, ovšem pro naše unikátní peptidy bylo nutno tyto konstanty zjistit experimentálně.
Disociační konstanty ionogenních skupin molekul je možné stanovit kapilární elektroforézou, což je rychlá, vysoce účinná separační technika s minimální spotřebou analyzované látky. Nabité sloučeniny (tedy i naše peptidy) putují kapilárou pod vlivem vloženého elektrického pole. Dochází k jejich separaci na základě rozdílných rychlostí pohybu, které jsou dány různou velikostí jejich náboje, molekulové hmotnosti a tvarem molekuly. Charakteristikou, kterou kapilární elektroforézou určujeme, je efektivní elektroforetická pohyblivost dané látky, tj. rychlost vztažená na jednotkovou intenzitu elektrického pole.
Křemenná kapilára, ve které analýza probíhá, obsahuje na své vnitřní stěně silanolové skupiny, které v roztoku při pH vyšším než 4 nesou záporný náboj. Toto je problém pro analýzu kladně nabitých molekul, neboť dochází k elektrostatickým interakcím a adsorpci molekul na stěnu kapiláry, což v důsledku může vést k chybně určeným elektroforetickým pohyblivostem. Bylo tedy třeba záporné silanolové skupiny „zamaskovat“, aby bylo možno provést měření pohyblivosti haliktinů v široké oblasti pH. Maskování se podařilo pomocí pokryvu vnitřního povrchu kapiláry. Na vnitřní stěnu kapiláry se střídavě nanáší vrstvy roztoků kladně a záporně nabitých molekul, poslední vrstva nese kladný náboj a díky odpuzování kladně nabitých peptidů od tohoto povrchu nedochází k jejich adsorpci na stěnu kapiláry. Takto jsme určili pohyblivosti haliktinů v širokém rozmezí pH a ze závislosti těchto pohyblivostí na pH jsme pomocí nelineární regresní analýzy vypočítali hodnoty disociačních konstant. Znalost těchto konstant nám pak umožnila vypočítat efektivní náboj haliktinů v prostředí o určitém, např. fyziologickém pH, což pomůže při objasňování jejich antimikrobiálního účinku.
Procesem dalšího využití těchto látek do konečné podoby nového druhu antibiotika se zabývají kolegové Ing. Terezy Tůmové v ÚOCHB AV ČR ze skupiny Antimikrobiálních peptidů a o tomto procesu si budete moci brzy přečíst další článek. Nové druhy léků se samozřejmě velmi dlouho testují, než jsou schváleny k používání.
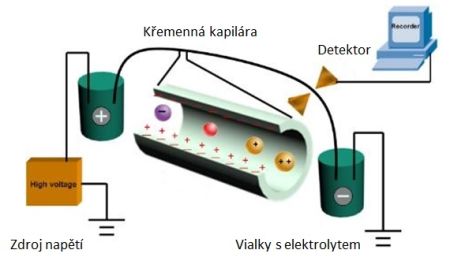
Schéma uspořádání přístroje pro kapilární elektroforézu.







